 چگونه دانشمندان بازنویسی کد حیات را یاد گرفتند!
اقتصاد ایران: فناوری ویرایش ژن به نوآوریهایی در پزشکی، تکامل و کشاورزی منجر شده و سؤالات اخلاقی عمیقی را درمورد تغییر DNA انسان ایجاد کرده است.
چگونه دانشمندان بازنویسی کد حیات را یاد گرفتند!
اقتصاد ایران: فناوری ویرایش ژن به نوآوریهایی در پزشکی، تکامل و کشاورزی منجر شده و سؤالات اخلاقی عمیقی را درمورد تغییر DNA انسان ایجاد کرده است.
به گزارش خبرگزاری اقتصادایران، ده سال پیش، جنیفر دودنا و همکارانش نتایج آزمایشی را که در ظرف آزمایشگاه روی ژنهای باکتریایی انجام داده بودند، منتشر کردند. زمانی که این مطالعه در تاریخ ۲۸ ژوئن ۲۰۱۲ در مجله ساینس منتشر شد، به عناوین خبری تبدیل نشد. درواقع، طی چند هفتهی بعد اصلا خبری دربارهی آن نبود. در آن زمان، دکتر دودنا تصور میکرد که شاید علت این مسئله عنوان ضعیفی بود که آنها برای مطالعه خود انتخاب کرده بودند. دکتر دودنا، بیوشیمیدان دانشگاه کالیفرنیا در برکلی در مصاحبهای گفت: «فکر میکنم اگر آن مقاله را امروز مینوشتم، عنوان دیگری برایش انتخاب میکردم.»
با وجود عنوان مبهم، این کشف به روش جدیدی برای ویرایش DNA اشاره داشت؛ روشی که ممکن بود حتی تغییر ژنهای انسان را نیز ممکن سازد. دودنا گفت: «وقتی مقاله را منتشر کردیم، فکر میکردم مانند شلیک تفنگ شروع مسابقه باشد.»
طی یک دهه، کریسپر به یکی از مشهورترین نوآوریها در زیستشناسی مدرن تبدیل شده است. این فناوری بهسرعت درحال تغییر نحوهی مطالعه بیماریها است: متخصصان زیستشناسی سرطان درحال استفاده از کریسپر برای کشف آسیبپذیریهای پنهان سلولهای تومور هستند. دانشمندان دیگر درحال استفاده از آن برای ویرایش ژنهایی هستند که موجب بیماریهای ارثی میشوند.
دیوید لیو، زیستشناس دانشگاه هاروارد میگوید: «دوران ویرایش ژن انسان شروع شده است.»
اما نفوذ کریسپر فراتر از علم پزشکی است. زیستشناسان تکاملی از این فناوری برای مطالعه مغز نئاندرتالها و بررسی اینکه چگونه اجداد کپی ما دم خود را از دست دادند، استفاده میکنند. متخصصان زیستشناسی گیاهی بذرهایی را ویرایش کردهاند تا محصولات دارای ویتامینهای جدید یا دارای مقاومت دربرابر بیماریها را تولید کنند. برخی از آنها ممکن است در چند سال آینده وارد بازار شود.
تأثیر کریسپر چنان سریع بوده است که دکتر دودنا و همکارش امانوئل شرپانتیه از واحد علوم پاتوژنها در مؤسسه ماکس پلانک آلمان جایزه نوبل شیمی سال ۲۰۲۰ را دریافت کردند. کمیتهی اهدای جایزه، مطالعه سال ۲۰۱۲ را «آزمایشی تاریخساز» خواند.

جنیفر دودنا، بهخاطر کار روی کریسپر، جایزه نوبل شیمی سال ۲۰۲۰ را دریافت کرد.
دکتر دودنا از همان ابتدا متوجه شد کریسپر سؤالات اخلاقی پیچیدهای را ایجاد میکند و اکنون، پس از یک دهه از توسعهی آن، این سؤالات بیش از هر زمان دیگری فوریت دارند.
آیا موج آتی محصولات کشاورزی تغییریافته به کمک کریسپر جهان را تغذیه میکنند و به کشاورزان فقیر کمک میکنند یا فقط غولهای تجارت کشاورزی که روی این فناوری سرمایهگذاری میکنند، ثروتمند میشوند؟ آیا پزشکی مبتنیبر کریسپر سلامت افراد آسیبپذیر را در کل جهان بهبود خواهد داد یا با قیمتی عرضه میشود که فقط ثروتمندان توانایی استفاده از آن را داشته باشند؟
عمیقترین سؤال اخلاقی درمورد کریسپر این است که چگونه نسلهای آینده میتوانند از این فناوری برای تغییر رویانهای انسان استفاده کنند.
ایده تغییر رویانهای انسان به کمک کریسپر تا سال ۲۰۱۸ صرفاً در حد آزمایشی فکری بود تا اینکه هی جیانکوی، بیوفیزیکدان چینی ژنی را در رویانهای انسانی ویرایش کرد تا دربرابر HIV مقاومت ایجاد کند. سه مورد از رویانهای اصلاحشدهی او در رحم زنی از شهر شنزن چین کاشته شدند.
در سال ۲۰۱۹، دادگاهی دکتر هی را به دلیل اقدامات پزشکی غیرقانونی به زندان محکوم کرد. امآیتی تکنولوژی ریویو در ماه آوریل گزارش کرد که او اخیراً آزاد شده است. اطلاعات چندانی درمورد سلامتی سه کودک مذکور که اکنون نوپا هستند، در دست نیست.
دانشمندان هنوز از فرد دیگری خبر ندارند که کار دکتر هی را تکرار کرده باشد. اما همانطور که کریسپر بیشتر پیشرفت میکند، ویرایش رویانهای انسانی ممکن است درنهایت به درمانی بیخطر و مؤثر برای انواع بیماریها تبدیل شود.
آیا در این صورت برای ترمیم ژنهای عامل بیماری در رویان در آزمایشگاه قابلقبول و عادی خواهد شد؟ اگر والدین بخواهند ویژگیهایی را وارد کنند که ازنظر آنها مطلوبتر است (مانند ویژگیهایی که به قد، رنگ چشم یا هوش مرتبط است)، چه رخ میدهد؟
فرانسواز بایلیس، متخصص اخلاق زیستی در دانشگاه دالهاوزی کانادا نگران است که عموم مردم هنوز آمادگی روبهرو شدن با چنین سؤالهایی را ندارند. او گفت: «من درمورد درک مشکلی که در اینجا وجود دارد و باید حل شود، تردید دارم. بین بهتر کردن افراد و ساختن افراد بهتر تفاوت وجود دارد.»
جنینشناسی که با دکتر هی جیانکوی کار میکند، ظرف حاوی رویانهای انسانی را که مولکولهای کریسپر به آنها تزریق شده است، در دست دارد (۲۰۱۸).
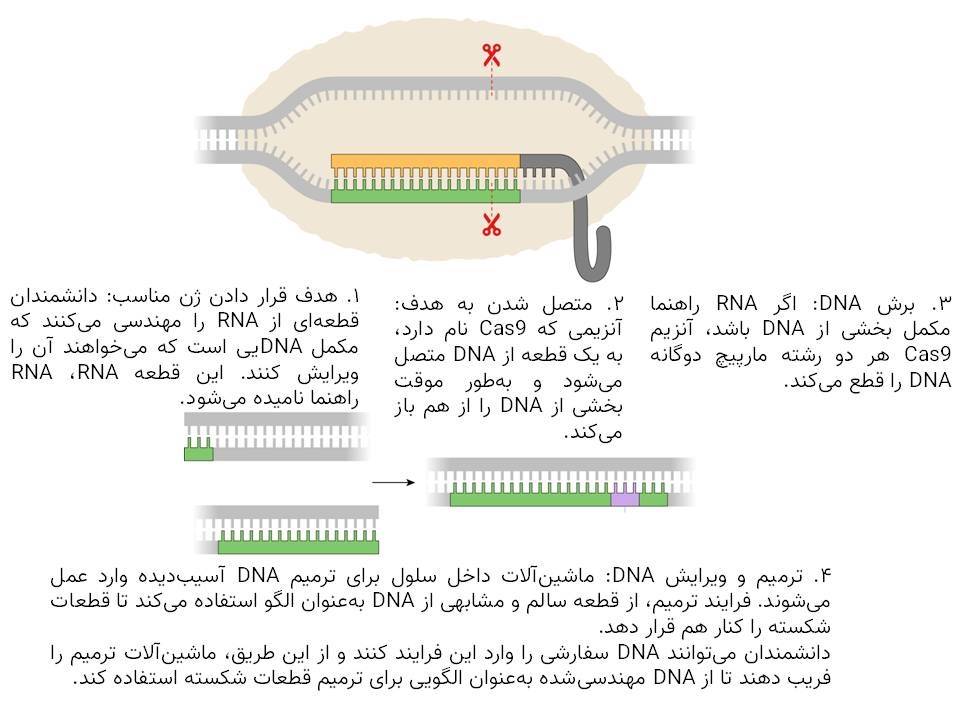
ایجاد برش
دکتر دودنا و دکتر شرپانتیه روش ویرایش ژن خود را از اساس اختراع نکردند. آنها ابزارهای مولکولی خود را از باکتریها گرفتند.
در دهه ۱۹۸۰، میکروبشناسان قطعات گیجکنندهای از DNA را در باکتریها کشف کردند که بعدا تناوبهای کوتاهِ پالیندرومِ فاصلهدارِ منظمِ خوشهای (یا به اختصار کریسپر) نام گرفتند. پژوهشهای بیشتر نشان داد باکتریها از این توالیهای کریسپر بهعنوان سلاحی دربرابر ویروسهای مهاجم استفاده میکنند.
باکتریها توالیهای مذکور را به ماده ژنتیکی به نام RNA تبدیل کرده بودند که میتوانست بهطور دقیق به قطعه کوتاهی از ژنهای ویروس مهاجم متصل شود. این مولکولهای RNA حاوی پروتئینهایی هستند که مانند قیچی مولکولی عمل میکنند و ژنهای ویروسی را برش میدهند و عفونت را متوقف میکنند.
همانطور که دکتر دودنا و دکتر شرپانتیه درحال بررسی کریسپر بودند، متوجه شدند که این سیستم ممکن است به آنها اجازه دهد تا یک توالی از DNA را به انتخاب خودشان برش دهند. تنها کاری که آنها باید انجام میدادند، این بود که قطعهی مکمل دقیقی از RNA را بسازند.
آنها برای آزمایش این ایده انقلابی، دستهای از قطعات مشابه DNA را ایجاد کردند. آنها سپس دسته دیگری از مولکولهای RNA را ساختند و همه آنها را برنامهریزی کردند تا روی نقطه یکسانی از DNA متصل شوند. آنها درنهایت DNA، RNA و قیچیهای مولکولی را با هم در لوله آزمایش مخلوط کردند و درنهایت دریافتند که بسیاری از مولکولهای DNA بهطور دقیقی در نقطه موردنظر برش خورده بودند.
دکتر دودنا برای چندین ماه روی آزمایشهای شبانهروزی نظارت داشت تا ببیند که آیا کریسپر میتواند علاوه بر لوله آزمایش در سلولهای زنده نیز عمل کند. او با این تصور که بسیاری از دانشمندان دیگر نیز درحال کار روی این مسئله هستند، از گروه خود میخواست بدون وقفه کار کنند. طولی نکشید که مشخص شد حدس او درست بوده است.
در ژانویه ۲۰۱۳، پنج تیم از دانشمندان مطالعاتی را منتشر کردند که در آن با موفقیت از کریسپر در سلولهای انسانی و حیوانی زنده استفاده کرده بودند. دکتر دودنا در آن رقابت پیروز نشد. دو مقاله اول را پژوهشگران آزمایشگاههایی در کمبریج ماساچوست (مؤسسه برود و مؤسسه فناوری ماساچوست) و دانشگاه هاروارد منتشر کردند.

امانوئل شرپانتیه، میکروبشناس فرانسوی از واحد علوم پاتوژنها مؤسسه ماکس پلانک آلمان که همراه با دکتر دودنا برنده جایزه نوبل شیمی سال ۲۰۲۰ شد.
آیا آن را کریسپر کردهاید؟
لوکاس داو، متخصص زیستشناسی سرطان در پزشکی وایل کرنل بهخوبی به خاطر میآورد که با خواندن مقالات مرتبط با کریسپر، به پتانسیل آن پی برد. دکتر داو و همکارانش بهزودی متوجه شدند که این روش بهطور قابل اعتمادی قطعات DNA را در سلولهای سرطانی انسان حذف میکند. دکتر داو گفت: «کریسپر به یک فعل تبدیل شد و بسیاری از مردم میگفتند: آیا آن را کریسپر کردید؟»
متخصصان زیستشناسی سرطان شروع به تغییر ژنها در سلولهای سرطانی کردند تا ببینند که کدامیک برای بیماری مهم است.
برای مثال، پژوهشگران شرکت کااسکیو تراپیوتیکس (KSQ Therapeutics) از کریسپر برای کشف ژنی استفاده کردند که برای رشد برخی تومورها ضروری است و سال گذشته کارآزمایی بالینی داروی مهارکننده آن ژن را آغاز کردند.
شرکت کاریبو بایوساینس (Caribou Biosciences) که دکتر دودنا همبنیانگذار آن است و شرکت کریسپر تراپیوتیکس (CRISPR Therapeutics) که دکتر شرپانتیه از مؤسسان آن است، هر دو درحال انجام کارآزماییهای بالینی برای درمانهای کریسپری هستند که به روش دیگری با سرطان مبارزه میکنند: با ویرایش سلولهای ایمنی تا با شدت بیشتری به تومورها حمله کنند. این شرکتها و چندین شرکت دیگر همچنین درحال استفاده از کریسپر برای معکوس کردن بیماریهای ارثی هستند.
در تاریخ ۱۲ ژوئن، پژوهشگرانی از شرکتهای کریسپر تراپیوتیکس و ورتکس (Vertex) در نشستی علمی نتایج جدیدی از کارآزمایی بالینی خود شامل ۷۵ داوطلب مبتلا به کمخونی سلولهای داسیشکل یا تالاسمی بتا را ارائه دادند. این بیماریها موجب نقصان هموگلوبین میشوند. هموگلوبین پروتئینی در سلولهای قرمز خون است که اکسیژن را حمل میکند.
پژوهشگران از این واقعیت سود بردند که انسانها بیش از یک ژن هموگلوبین دارند. یک نسخه به نام هموگلوبین جنینی معمولاً فقط در جنین فعال است و طی چند ماه پس از تولد غیرفعال میشود. آنها سلولهای خونی نابالغ را از مغز استخوان داوطلبان استخراج کردند. پژوهشگران سپس از کریسپر استفاده کردند تا کلیدی را که بهطور معمول ژن هموگلوبین جنینی را غیرفعال میکند، حذف کنند. وقتی سلولهای ویرایششده به بیماران بازگردانده شدند، توانستند به سلولهای قرمز خون پر از هموگلوبین تبدیل شوند.
پژوهشگران در کنفرانس هماتولوژی، گزارش کردند که از ۴۴ بیمار مبتلا به تالاسمی بتا که تحت درمان قرار گرفتند، ۴۲ نفر، دیگر به انتقال منظم خون نیازی نداشتند. هیچیک از ۳۱ بیمار مبتلا به کمخونی سلول داسیشکل دچار افت دردناک اکسیژن که معمولاً آنها را به بیمارستان میفرستاد، نشد.
شرکتهای شرکتهای کریسپر تراپیوتیکس و ورتکس انتظار دارند که تا پایان سال از سازمانهای ناظر بخواهند رویکرد درمانی آنها را تأیید کند.
شرکتهای دیگر درحال تزریق مستقیم مولکولهای کریسپر به بدن هستند. برای مثال، شرکت اینتلی تراپیوتیکس (Intellia Therapeutics) که در کمبریج قرار دارد و دکتر دودنا نیز همبنیانگذار آن است، با شرکت ریجنران (Regeneron) که در نیویورک قرار دارد، همکاری کرده است تا کارآزمایی بالینی را برای درمان آمیلوئیدوز ترانستیرتین آغاز کند. آمیلوئیدوز ترانستیرتین بیماری نادری است که در آن یک پروتئین معیوب کبد در خون تجمع پیدا میکند و میتواند موجب مرگ شود.
پزشکان مولکولهای کریسپر را به کبد داوطلبان تزریق کردند تا ژن معیوب را غیرفعال کنند. پژوهشگران اینتلی در کنفرانس علمی اخیر خود گزارش کردند که یک دوز از این درمان باعث کاهش قابلتوجه سطح پروتئین معیوب در خون داوطلبان شده است.
همان فناوری که به پژوهشگران پزشکی اجازه میدهد تا سلولهای انسانی را اصلاح کنند، به دانشمندان کشاورزی کمک میکند تا ژنهای محصولات کشاورزی را تغییر دهند.
وقتی موج اول مطالعات کریسپر منتشر شد، کاترین فویه، متخصص گندم که در آن زمان در مؤسسه تحقیقات کشاورزی فرانسه کار میکرد، بلافاصله پتانسیل کریسپر را برای کار خود درک کرد.
در شرکت ایناری اگریکالچر (Inari Agriculture)، دکتر فویه بر تلاشها برای استفاده از کریسپر برای ایجاد ارقامی از سویا و محصولات دیگر که آب و کود کمتری مصرف کنند، نظارت میکند. در خارج از ایالات متحده، پژوهشگران بریتانیایی از کریسپر برای تولید گوجهفرنگی استفاده کردهاند که میتواند ویتامین دی تولید کند.
کوین پیکسلی، دانشمند گیاهشناس مرکز بینالمللی بهبود ذرت و گندم در مکزیکوسیتی گفت که کریسپر برای اصلاح گیاهان نه فقط به این خاطر که قدرتمند است، بلکه به این علت که نسبتاً ارزان است، اهمیت دارد. حتی آزمایشگاههای کوچک هم میتوانند کاساوای مقاوم به بیماری یا موز مقاوم دربرابر خشکسالی ایجاد کنند که میتواند به نفع کشورهای فقیر باشد، اما شرکتهایی که بهدنبال بازده مالی بالا هستند، به آن علاقهمند نیستند.
به دلیل استفاده از کریسپر در صنایع متعدد، حق ثبت اختراع آن موضوع اختلافی طولانی بوده است. گروههایی که تحت سرپرستی مؤسسه برود و دانشگاه کالیفرنیا قرار دارند، هر دو حق ثبت اختراع را برای نسخه اصلی ویرایش ژن براساس CRISPR-Cas9 در سلولهای زنده ثبت کردند. مؤسسه برود در سال ۲۰۱۴ یک حق ثبت اختراع را گرفت و دانشگاه کالیفرنیا از این مسئله شکایت کرد. در فوریه سال جاری، دادگاه مسئول به نفع مؤسسه برود حکم داد.
جاکوب شرکو، کارشناس ثبت اختراعات بیوتکنولوژی در دانشکده حقوق دانشگاه ایلینوی پیشبینی کرد شرکتهایی که مجوز فناوری کریسپر را از دانشگاه کالیفرنیا دریافت کردهاند، باید حق ثبت اختراع مؤسسه برود را به رسمیت بشناسند. او گفت: «شرکتهای بزرگی که میخواهند از کریسپر استفاده کنند، باید پول زیادی به مؤسسه برود بدهند.»

دکتر ژانگ از مؤسسه برود که اخیراً طی یک منازعه، حق ثبت اختراع فناوری کریسپر را به دست آورد.
کریسپر بنیادی
سیستم کریسپر ابتدایی که با نام CRISPR-Cas9 شناخته میشود، جای زیادی برای پیشرفت دارد. مولکولها در بریدن DNA خوب هستند، اما ازنظر وارد کردن قطعات جدید در جای خود خیلی خوب نیستند.
گاهیاوقات CRISPR-Cas9 هدف خود را گم میکند و DNA را در مکان نامناسبی برش میدهد. حتی زمانی که این مولکولها وظایف خود را به درستی انجام میدهند، سلولها ممکن است حین ترمیم انتهای باز DNA دچار اشتباه شوند.
تعدادی از دانشمندان نسخههای جدیدی از کریسپر را اختراع کردهاند که برخی از این کاستیها را رفع میکند. برای مثال، در دانشگاه هاروارد، دکتر لیو و همکارانش از کریسپر برای ایجاد شکاف در یکی از دو رشته DNA استفاده کردهاند، بهجای اینکه آن را بهطور کامل برش دهد. این فرایند که «ویرایش باز» نامیده میشود، به آنها اجازه میدهد که بهطور دقیق یک حرف ژنتیکی (باز) از DNA را تغییر دهند که خطر آسیب ژنتیکی بسیار کمی را به همراه دارد.
دکتر لیو هم شرکتی به نام بیم تراپیوتیکس (Beam Therapeutics) را تأسیس کرده است تا داروهای ویرایشکننده بازها را ایجاد کنند. اواخر امسال، این شرکت اولین داروی خود را روی افراد مبتلا به کمخونی سلول داسیشکل آزمایش خواهد کرد.
دکتر لیو و همکارانش همچنین مولکولهای کریسپر را به پروتئینی متصل کردهاند که ویروسها از آن برای وارد کردن ژنهای خود به DNA میزبان استفاده میکنند. این روش جدید که ویرایش بنیادی نام دارد، میتواند کریسپر را قادر سازد تا قطعات طولانیتری از مواد ژنتیکی را تغییر دهد. دکتر لیو گفت: «ویرایشگرهای بنیادی بهنوعی شبیه پردازندههای کلمات DNA هستند. آنها درواقع یک تابع جستوجو و جایگزینی را روی DNA اجرا میکنند.»
رودالفی بارانگو، متخصص کریسپر در دانشگاه ایالتی کارولینای شمالی و از مؤسسان شرکت اینتلی تراپیوتیکس پیشبینی کرد که ویرایش بنیادی درنهایت به بخشی از جعبه ابزار استاندارد کریسپر تبدیل شود. اما بهگفتهی او، درحالحاضر این روش هنوز بهقدری پیچیده است که نمیتواند بهطور گسترده مورد استفاده قرار گیرد.
نوزادان ویرایش ژنی شده

دکتر هی در سال ۲۰۱۸ در در دانشگاه هنگکنگ ادعا کرد که اولین نوزادان دوقلوی ازنظر ژنتیکی ویرایششده را ایجاد کرده است.
در سال ۲۰۱۸ وقتی دکتر هی تصمیم گرفت در شنزن چین رویانهای انسان را ویرایش کند، هنوز پیشرفتهایی مانند ویرایش بنیادی وجود نداشت. او از سیستم استاندارد CRISPR-Cas9 استفاده کرد که دکتر دودنا و دیگران سالها پیش آن را ایجاد کرده بودند.
دکتر هی امیدوار بود با بریدن قطعهای از ژن CCR5 از DNA رویانها، به نوزادان مقاومت دربرابر HIV بدهد. افرادی که بهطور طبیعی حامل این جهش هستند، بهندرت دچار عفونت HIV میشوند. در نوامبر ۲۰۱۸، دکتر هی اعلام کرد که یک جفت دختر دوقلو با ویرایشهای ژنی او متولد شدهاند. این خبر دانشمندانی مانند دکتر دودنا را حیرتزده کرد و او را بهخاطر اینکه سلامت نوزادان را با رویههای آزمایشنشده به خطر انداخته است، بهشدت سرزنش کردند.
دکتر بایلیس، از دانشگاه دالهاوزی، از دکتر هی بهخاطر نحوه ارائه این روش به والدین انتقاد کرد چراکه گفته میشود او آزمایش مهمی را که آنها قرار بود، انجام دهند، کماهمیت جلوه داده بود. او گفت: «نمیتوانستید رضایت آگاهانه را دریافت کنید، مگر اینکه وعده واهی میدادید. کسی هرگز این کار را انجام نداده بود.»
در تقریباً چهار سال پس از اعلام دکتر هی، دانشمندان به استفاده از کریسپر روی رویانهای انسان ادامه دادهاند؛ اما آنها رویانهای انسان را فقط تا زمانی مطالعه میکنند که تودههای کوچکی از سلول هستند تا سرنخهایی درمورد اولین مراحل رشد آنها پیدا کنند. این مطالعات بهطور بالقوه میتواند به درمانهای جدیدی برای ناباروری منجر شود.
بیکه بکائرت، دانشجوی زیستشناسی تولیدمثل در دانشگاه گنت بلژیک میگوید استفاده از کریسپر در رویانهای انسان چالشبرانگیز است. شکستن DNA در این سلولها میتواند به بازآرایی شدید کروموزومها منجر شود. او که نویسنده اصلی مطالعه مروری اخیری درمورد این موضوع است، گفت: «دشوارتر از چیزی است که فکر میکردیم. واقعاً نمیدانیم چه اتفاقی میافتد.»
بااینحال، خانم بکائرت امیدوار است ویرایش بنیادی و پیشرفتهای دیگر درزمینه کریسپر به دانشمندان اجازه دهد تا تغییرات دقیق قابل اعتمادتری را در رویانهای انسانی ایجاد کنند. او گفت: «پنج سال خیلی زود است، اما فکر میکنم در طول زندگی من اتفاق خواهد افتاد.»